Todos os peixes são iguais? Como os peixes vivem? Quais são as
adaptações dos peixes que lhes permitem viver no ambiente aquático?
|
Peixes, anfíbios, répteis, aves e mamíferos são exemplos de
classes de animais que tem em comum uma característica bem peculiar: a coluna
vertebral. Observe e compare a variedade de esqueletos demonstrada nas figuras 1 e 2 abaixo:


Figura 1: tubarão Figura
2: raia
As características
dos peixes:
Dentro da classe dos peixes podemos classificá-los em dois
grupos diferentes, observando a característica de seus esqueletos. Podemos
dividi-los em: peixes ósseos, cujos esqueletos são formados por material
cartilaginoso (são o caso das arraias e tubarões); e peixes ósseos, a maioria deles, que tem seu
esqueleto formado por material ósseo (exemplos lambaris, bagres, enguias).

Figura 4: Peixe palhaço, moréia, cavalo-marinho: Possuem
esqueleto ósseo
Fatores físicos e químicos que interferem na vida dos peixes:
A respiração dos peixes depende do gás oxigênio que fica
dissolvido na água. Assim, a taxa de oxigênio da água é um dos principais
fatores que podem limitar a vida dos peixes em determinado ambiente. Enquanto
no ar o gás oxigênio é abundante, na água esse gás é mais escasso. Peixes mais
exigentes em relação ao gás oxigênio não vivem em qualquer ambiente de água
doce. Outros têm adaptações que lhes permitem viver em águas com menor
quantidade de gás oxigênio dissolvido.
Textos de apoio: Para
aumentar seus conhecimentos sobre peixes, que tal ler este artigo?
http://www.aquaonline.com.br/
Você já notou como é difícil andar dentro de uma piscina?
|
O meio aquático, quando comparado ao ar, oferece grande
resistência ao deslocamento voluntário de um ser vivo. Chamamos de viscosidade
a propriedade de líquidos e gases de oferecer resistência ao escoamento. Nos
líquidos a viscosidade é maior que nos gases porque suas partículas ligam-se
mais fortemente entre si do que as partículas dos gases. Assim, os peixes têm
características, como o formato do corpo, que lhes permitem o deslocamento num
ambiente de alta viscosidade.

Figura 5: O formato fusiforme permite
ao peixe melhor deslocamento embaixo da água.
Adaptações dos peixes a vida aquática:
As formas que favorecem o deslocamento em meio aquático são
chamadas de hidrodinâmicas, pois “cortam” a água com mais facilidade.
Você já reparou na forma da grande maioria dos peixes que nadam
rapidamente?
|
Formas hidrodinâmicas são aquelas que reduzem a resistência
da água quando o animal se desloca, e, portanto, reduzem o gasto de energia dos
músculos que promovem a natação.
A habilidade dos peixes para a natação deve-se à forma
hidrodinâmica do corpo e a sua pele com escamas e muco protetor. Esses
elementos reduzem o efeito da viscosidade da água.

Figura 6: Observe a foto ao lado e veja a
forma hidrodinâmica dos peixes.
Os nutrientes são obtidos a partir do alimento ingerido (por
exemplo, larvas de insetos, insetos adultos, peixes pequenos, crustáceos,
plâncton) e o gás oxigênio é obtido pelo sangue durante a passagem da água
pelas brânquias.
As brânquias são estruturas filamentosas com grande
quantidade de vasos sanguineos que ficam numa abertura lateral do corpo dos
peixes por onde circula a água que entra pela boca. É nas brânquias que ocorrem as trocas gasosas entre o sangue
do peixe e a água: o gás oxigênio que está dissolvido na água atravessa a fina
membrana das brânquias e passa para o sangue; o gás carbônico resusltante da
respiração das células do peixe passa para dos vasos sanguineos para a água que
está em contato com as brânquias.
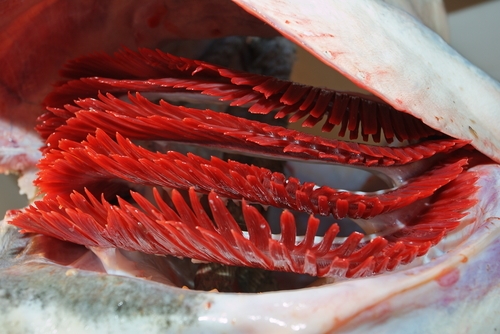
Figura 7: Demonstração das brânquias em um peixe.


Figura 7: Demonstração das brânquias em um peixe.

Figura 8:Foto detalhe do
conjunto de brânquias
Para aumentar os seu conhecimentos, que tal ler esse artigo?
Resumo:
Peixes são animais vertebrados. Dentro deste filo dos
vertebrados podemos classificá-los em peixes cartilaginosos e peixes ósseos.
Devido o seu hábitat ser exclusivamente aquático, os peixes desenvolveram
mecanismos de adaptação para viver embaixo da água. Alguns desses mecanismos
são as brânquias, cuja principal função é captar o oxigênio dissolvido na água;
e a forma hidrodinâmica que possibilita a melhor mobilidade desses animais
embaixo da água.
Atividades de
aprendizagem:
Observação de peixes ornamentais:
Como um peixe respira? Que movimentos são necessários para a sua
respiração?
|
Uma das ações dos cientistas que os ajudam a compreender a
natureza é a observação. Para responder às perguntas acima, procure direcionar
a sua atenção para o modo com um peixe se desloca e a relação existente entre
os movimentos da boca e do opérculo.
Veja o vídeo abaixo e depois responda as questões abaixo:
1 – Quando a boca do peixe está aberta, o opérculo também
está?
2 – Quando a boca do peixe está fechada, o opérculo está
fechado ou aberto?
3 - Observe a natação do peixe e relacione os tipos de
deslocamento( para cima, para baixo, para a direita, rápido e lento) com o tipo
de movimentação das nadadeiras. Como e
quais são as nadadeiras que se movem quando o peixe se desloca rapidamente?
4 – As nadadeiras ficam totalmente paradas quando o peixe
não está se deslocando?
Bibliografia:
http://mundoebias62.blogspot.com.br/2009/10/estudos-dos-vertebrados.html
acesso em 18 de junho de 2012.
http://www.youtube.com/watch?v=cWZy3_NORe8
acesso em 18 de junho de 2012.
http://www.infoescola.com/peixes/branquias/ acesso em 18 de junho de 2012.






